Tryptophane
| Tryptophane | |
|---|---|
 L ou S(–)-tryptophane 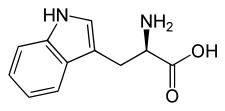 D ou R(+)-tryptophane |
|
| Identification | |
| Nom UICPA | acide 2-amino-3-(1H-indol-3-yl)propanoïque |
| Synonymes |
W, Trp |
| No CAS |
54-12-6 (racémique) 73-22-3 (L) ou S(–) 153-94-6 (D) ou R(+) |
| No EINECS | 200-795-6 (L) |
| Code ATC | N06AX02 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule brute | C11H12N2O2 [Isomères] |
| Masse molaire1 |
204,2252 ± 0,0106 g/mol C 64,69 %, H 5,92 %, N 13,72 %, O 15,67 %, |
| Propriétés physiques | |
| T° fusion | 290,5 °C (décomposition) |
| Solubilité | 13.1 g.L−1 dans l'eau à 25°C2 |
| Propriétés biochimiques | |
| Codons | UGG |
| pH isoélectrique | 5,893 |
| Acide aminé essentiel | oui |
| Occurrence chez les vertébrés | 1,3 %4 |
|
|
|
Le tryptophane (abréviations IUPAC-IUBMB : Trp et W) est un acide α-aminé dont l'énantiomère L est l'un des 22 acides aminés protéinogènes, et l'un des 9 acides aminés essentiels pour l'Homme. Il est encodé sur les ARN messagers par le codon UGG.
Propriétés
Il est aromatique, apolaire et hydrophobe (comme la phénylalanine). Très fragile, il est détruit par les acides minéraux, et ne peut être isolé dans les hydrolysats acides des protéines. C'est un acide aminé contenant un hétérocycle indole qui lui confère des propriétés spectroscopiques d'absorption et de fluorescence dans l'UV. En dehors de son utilisation dans la biosynthèse des protéines, c'est le précurseur d'autres composés importants comme la sérotonine, la mélatonine, ou encore la bufoténine.
Biosynthèse et production
Seuls les micro-organismes et les plantes sont capables de synthétiser le tryptophane. Cette voie de biosynthèse utilise le chorismate ou l'anthranilate comme point de départ. Celui-ci est condensé sur du phosphoribosyl pyrophosphate (PRPP). Le cycle furanose de ce dernier est ensuite ouvert. Après décarboxylation réductive, il se forme de l'indole-3-glycérol-phosphate. Ce dernier est transformé en tryptophane en deux étapes, d'abord en indole, puis en tryptophane, par la tryptophane synthase. Cette enzyme sert également dans le cadre de procédés industriels pour la biotransformation de l'indole en tryptophane.
Occurrence chez l'homme
Dans l'organisme humain, le tryptophane est indispensable et représente environ 1 % des acides aminés présents dans les protéines (le plus rare des 20 acides aminés). Il est cependant requis pour la synthèse de la sérotonine et de la mélatonine, ainsi que pour la production d'une variété de métabolites appelés collectivement les kynurénines.
La production de la sérotonine dans le cerveau varie directement en fonction du transport du tryptophane dans le cerveau (au travers de la barrière hémato-encéphalique). Le taux de transport est lui-même inversement proportionnel aux concentrations des autres grands acides aminés neutres (leucine, isoleucine, valine, tyrosine, phénylalanine) qui lui font compétition à l'entrée du cerveau. Les concentrations de ces derniers, enfin, varient en fonction de la proportion en glucides et en protéines consommées. C'est ainsi que la consommation de sucre ou de repas sucrés aura pour effet d'augmenter indirectement les concentrations de tryptophane dans le cerveau, tandis qu'un aliment très protéiné (qui, paradoxalement, contient plus de tous les acides aminés, y compris le tryptophane), aura pour effet de diminuer les concentrations cérébrales de tryptophane et, probablement, de sérotonine.
Certains constituants alimentaires facilitent à notre organisme la synthèse de sérotonine, neuromédiateur qui régule notre humeur, notre comportement alimentaire et nous prépare au sommeil. Certaines situations physiologiques comme un régime hypocalorique par exemple, peuvent entraîner une baisse de sécrétion de la sérotonine, souvent responsable de stress, de fatigue psychique, de troubles du sommeil. Certains aliments sont riches en tryptophane : œufs, noix de coco, lactosérum ; d'autres en sont pauvres : maïs, carottes, chou.
Dans le cerveau, le tryptophane est hydroxylé par une enzyme, la tryptophane hydroxylase et transformé en 5-hydroxytryptophane. Ce 5-HTP est décarboxylé (en présence de vitamine B6) pour donner la sérotonine. Des suppléments de tryptophane et de son métabolite, le 5-hydroxytryptophane ou 5-HTP, favorisent la sécrétion de sérotonine. Plusieurs études ont établi leur intérêt dans le traitement de la dépression.
C'est le chercheur américain Richard Wurtman qui découvrit la forme L-tryptophane dans des travaux qui le conduisirent ensuite à des développements dans le domaine des fenfluramines.
Cas d'empoisonnement
En 1989, la compagnie japonaise Showa Denko commercialisait aux États-Unis du tryptophane comme supplément alimentaire produit par manipulation génétique d'une bactérie. On assista alors à une épidémie d’une nouvelle et mystérieuse maladie, le syndrome éosinophilie–myalgie qui causait des douleurs musculaires Par la suite, on relia cette maladie à la consommation du tryptophane transgénique, imputable à une mauvaise filtration qui laissait passer un contaminant. Ce tryptophane tua 37 personnes et en rendit 1500 autres infirmes. Il s'agit d'une véritable catastrophe industrielle liée à un produit obtenu par manipulation génétique commercialisé. L'utilisation de bactéries génétiquement modifiées pour produire de grandes quantités de tryptophane a mené à une production également importante d'impuretés.
Sources alimentaires de tryptophane
- Le riz complet
- Les produits laitiers
- La viande
- Les arachides
- Les protéines de soja
- Les œufs
- Le poisson
- Les légumineuses
- Le chocolat
- La banane
- Les amandes et les noix de cajou
- La levure de bière
Effets du L-tryptophane sur la somnolence et sur le sommeil.
Abstrait
Au cours des 20 dernières années, 40 études contrôlées ont été décrites concernant les effets du L-tryptophane sur la somnolence et / ou le sommeil chez l'humain. Le poids de la preuve indique que le L-tryptophane à des doses de 1 g ou plus produit une augmentation de la somnolence subjective évaluée et une diminution de la latence du sommeil (temps de sommeil). Il y a moins de données fermes suggérant que le L-tryptophane peut avoir des effets supplémentaires tels qu'une diminution de l'éveil total et / ou une augmentation de la durée du sommeil. Les meilleurs résultats (en termes d'effets positifs sur le sommeil ou la somnolence) ont été observés chez des sujets souffrant d'insomnie légère, ou chez des sujets normaux présentant une latence du sommeil supérieure à la moyenne. Des résultats mitigés ou négatifs se produisent chez des sujets entièrement normaux - qui ne sont pas des sujets appropriés car il n'y a pas de place pour l'amélioration. Des résultats mitigés sont également signalés chez les insomniaques sévères et chez les patients atteints de maladie grave, qu'elle soit médicale ou psychiatrique.
- PMID:
- 6764927
